国家发展改革委等部门关于印发《电解铝行业节能降碳专项行动计划》的
电镀厂重金属废水处理试验研究
电镀厂重金属废水处理试验研究北极星环保网讯:摘要:本文根据具体实验入手,针对电镀重金属废水的处理展开了试验研究,通过详细阐述了试验的方法,并对试验所得结果作相关分析讨论,实验证明,
北极星环保网讯:摘要:本文根据具体实验入手,针对电镀重金属废水的处理展开了试验研究,通过详细阐述了试验的方法,并对试验所得结果作相关分析讨论,实验证明,该处理方法能有效处理重金属废水,使得处理后的废水达到排放标准,以为有关方面提供有益的参考借鉴。
关键词:电镀厂;废水;排放;处理
电镀行业重金属废水已经成为对环境污染最严重的工业废水之一,电镀废水中含有大量重金属,一旦处理不当而排入河道将严重污染自然环境。因此,对电镀重金属废水进行有效处理具有极大的现实意义。在实际所需处理的电镀废水中含有的重金属并不是单一种类,往往多种重金属并存,现针对此进行试验研究,以探索研究出针对性的科学有效处理方法,以使重金属废水的处理达到排放标准。
1 实验部分
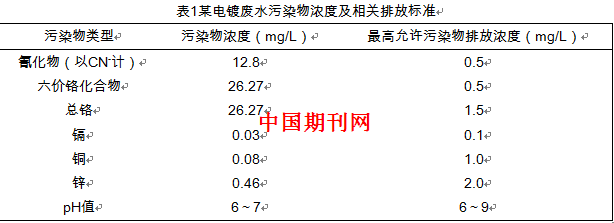
1.1 原水水质
实验所用原水为某电镀厂的电镀废水,该电镀废水的污染物浓度及相关排放标准如表1所示。
1.2 实验方法
该电镀废水中所含氰化物和六价铬超过《电镀污染物排放标准》(GB21900—2008)中所规定的最高允许排放浓度,因此,该电镀厂的电镀废水处理主要考虑降低该浓度,使其达到排放标准。
含氰含铬废水的处理方法有很多,通过对常用处理方法的对比,拟采用臭氧破氰法去除废水中氰化物,用FeSO4-Ca(OH)2还原沉淀法去除原水中的六价铬化合物。由于原水中含六价铬化合物浓度较高,单纯化学法可能不能去除完全,拟再采用纳滤法处理化学还原沉淀后的上清液,使出水各种重金属离子浓度进一步降低,达到《电镀污染物排放标准》(GB21900—2008)中所规定的排放标准。
1.2.1 臭氧破氰实验
臭氧能够氧化氰化物和硫氰酸盐,其化学反应方程式如下:
CN-+O3——CNO-+O2↑
2CNO-+3O3+H2O——N2↑+2HCO3-+302↑
2SCN-+11O3+4OH-——2HCO3-+2SO32-+N2↑+3H2O+11O2↑
本次实验所用臭氧由臭氧发生器制得。取两份原水水样各1000mL,分别标记为水样1和水样2,将水样1的pH值调节至9~11,水样2不作调整(pH值为6~7)以作对比。分别用上述臭氧发生器制得的臭氧曝气,进行臭氧破氰,测定出水中总氰化物的浓度。实验条件和参数如表2所示。

水样2 1000 9~11 2.5 25
1.2.2 硫酸亚铁—氢氧化钙法处理含铬废水实验
含铬废水在酸性条件下,用硫酸亚铁将Cr(VI)还原为Cr3+,再加入氢氧化钙作沉淀剂,使Cr3+及其他金属离子沉淀下来。反应式如下:
Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O
Cr3++3OH-=Cr(OH)3↓
Fe3++3OH-=Fe(OH)3↓
用硫酸亚铁—氢氧化钙法处理含铬废水,还原时的pH值、还原剂硫酸亚铁的投加量、沉淀剂氢氧化钙的投加量都对去除效果有一定程度的影响。
①pH值对Cr(VI)去除率的影响。由化学反应式计算得到,还原剂FeSO4•7,H2O与Cr(VI)的质量比约为16:1,但实际上往往会高于理论值。于是,取含Cr(VI)=26.27mg/L的原水样6份,每份各50mL于50mL具塞比色管中,每份水样中按FeSO4•7H2O:Cr(VI)=25:1加入FeSO4•7,H2O后,再分别用稀HCl调节溶液的pH值,充分反应后加入过量Ca(OH)2进行沉淀,沉淀完全后测定上清液中Cr(VI)的浓度,得出该反应的最佳pH值。
②FeSO4•7H2O投加量对Cr(VI)去除率的影响。取含Cr(VI)=26.27mg/L的原水样6份,每份各50mL于50mL具塞比色管中,分别加入稀HCl调节溶液的pH值至①实验中得到的最佳pH值,每份水样按不同的还原剂投加比加入FeSO4•7H2O,充分反应后加入过量Ca(OH)2进行沉淀,沉淀完全后测定上清液中Cr6+的浓度,得出最佳FeSO4•7H2O投量。
③Ca(OH)2投加量对Cr3+沉淀效果的影响。取含Cr(VI)=26.27mg/L的原水样6份,每份各50mL于50mL具塞比色管中,分别加入稀HCl调节溶液的pH至①实验中得到的最佳pH值,每份水样中按②实验得出的最佳FeSO4•7H2O投量加入FeSO4•7H2O,充分反应后按不同的沉淀剂投加比加入Ca(OH)2进行沉淀,沉淀完全后测定上清液中Cr3+的浓度,得出最佳Ca(OH)2投加量。
上一篇:浅谈废水监测分析中的质量控制对策



无相关信息