国家发展改革委等部门关于印发《电解铝行业节能降碳专项行动计划》的
电化学氧化法处理低浓度氨氮污水的研究
电化学氧化法处理低浓度氨氮污水的研究水处理网讯:摘 要:本文采用电化学氧化法去除低浓度氨氮污水,利用正交实验的方法探究了 Ph、电流密度、氯离子添加量、电化学氧化时间、板极类型对氨
水处理网讯:摘 要:本文采用电化学氧化法去除低浓度氨氮污水,利用正交实验的方法探究了 Ph、电流密度、氯离子添加量、电化学氧化时间、板极类型对氨氮去除效果的影响。结果表明,最优水平组合为 pH=7,电解时间为 90min,氯离子浓度为 2000mg/L,电流密度 为 20mA/cm2,电极板组合为铱钽钛板-316 不锈钢。
关键词:电化学氧化;氨氮;电流密度;板极类型
1 概述
氨氮是水体中的营养素,可导致水富营养化现象产生,是水体中的主要耗氧污染物,对水中生物及人类都有较大危害性。目前,国内外氨氮废水的处理方法主要有气浮法、折点加氯法、电化学氧 化法、离子交换法、物理吸附法和生物脱氨法等。其中,电化学氧化 法由于具有占地面积少、操作简单、绿色清洁等优点而引起广泛关 注。
2 实验部分
2.1 原理介绍
电化学氧化过程按照作用机理的不同,可分为直 接电化学氧化和间接电化学氧化。最终产物主要为氮气,含少量NO2-,NO3-。
2.1.1 直接电化学氧化法
2.1.1.1 氨氮直接在阳极表面失去电子被氧化去除。此过程中,氨氮先吸附在阳极表面,后直接与阳极之间发生三电子转移反应。 如公式(1)所示。

氨氮发生直接电化学氧化必须满足两个必要条件:一是需要碱性介质条件,以保证部分氨氮以游离态 NH3 存在;二是合适的阳 极电位。
2.1.1.2 氨氮被吸附态羟基自由基氧化去除
当使用电催化性能 较强的金属氧化物阳极时,吸附在电极表面的水分子与阳极氧化 物空穴反应生成吸附的羟基自由基(·OH),如公式(2)所示。氨氮被吸附的羟基自由基有效地氧化成氮气和水,如公式(3)所示。
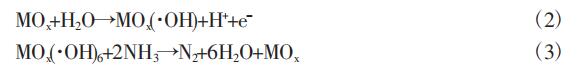
2.1.2 氨氮间接电化学氧化
该过程是通过阳极反应先生成强 氧化剂,然后强氧化剂与氨氮反应,使氨氮降解脱除。氨氮的间接 电化学氧化,根据氯离子(Cl-)的存在状况可分成有氯离子存在和无氯离子存在两种形式。
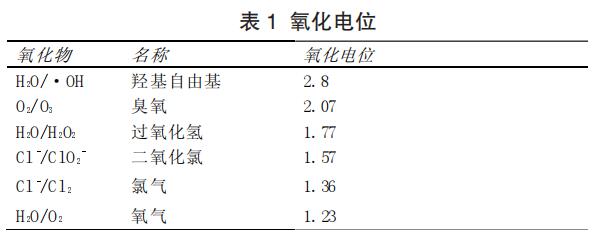
2.1.2.1 废水中存在氯离子时,氨氮的电化学氧化反应接近于 “折点加氯除氮”的反应过程。水中的氯离子先发生阳极反应生成 活性氯(Cl2、HOCl、Cl O-等),其氧化电位见表 1,然后氧化性很强的活性氯再与氨氮反应,从而达到去除氮的目的,如图 1 所示。 将氯气或者次氯酸钠通入污水中将其中的氨氮氧化成氮气的 方法叫做折点氯化法。法氯气在水中不仅会溶解还会发生反应,当 氯气通入污水中达到一定剂量时水中游离氯的含量有一最低值, 此时能够将氨氮完全降解。当氯气加入量超过该点时,水中游离氯 含量增大而对去除效果没有改变,这个能达到最好去除效果而又不造成氯气浪费的最佳剂量点就是折点。
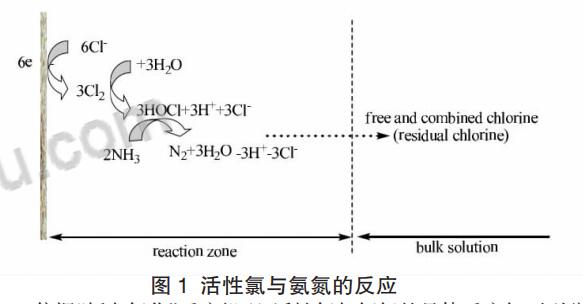
依据“折点氯化”反应机理,活性氯与氨氮的具体反应如下列公式。
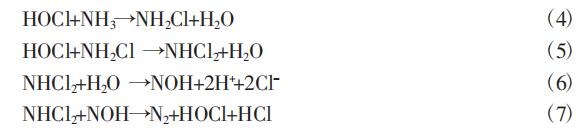
此外,活性氯与氨氮的反应过程中也会有一些副反应的发生, 如析氧反应、析氢反应以及消耗活性氯的反应等,如下列公式。
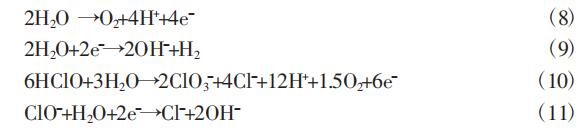
2.1.2.2 氨氮废水不含氯离子时,氨氮主要是被电化学反应过程中产生的羟基自由基氧化而去除。羟基自由基可以由水或OH(- 碱 性条件下)在阳极氧化产生,其电极反应如下:

羟基自由基一种很强的氧化剂,其氧化电极电位高达 2.8V(vs.SHE),分别比 H2O2的 1.76 V 和 O3的 2.07 V 高 59%和 35%,也比 其它一些常用的强氧化剂如 KMnO4、Cl2 和 Cl O2 的氧化电极电位高。同时,羟基自由基的电子亲和能力为 569.3KJ,具有很高的电负性或亲电性,能够对氨氮进行有效的氧化。氨氮可以被羟基自由基氧化为氮气和水。

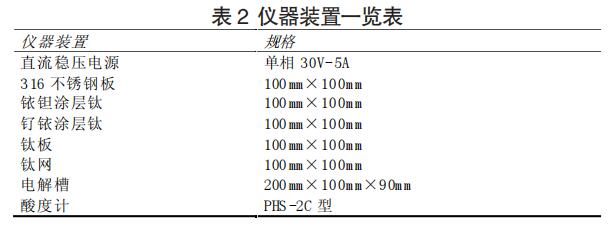
2.2 实验装置
本次实验的主要仪器装置一览表见 2。
2.3 实验方法
实验原水采用模拟氨氮污水,每次实验用水量为1L,采用硫酸铵配制模拟氨氮污染液,浓度为为 8mg/L(以 NH4计)。氨氮的测定采用《水质氨氮的测定纳氏试剂分光光度法(HJ535—2009)》,pH 的测定使用酸度计。
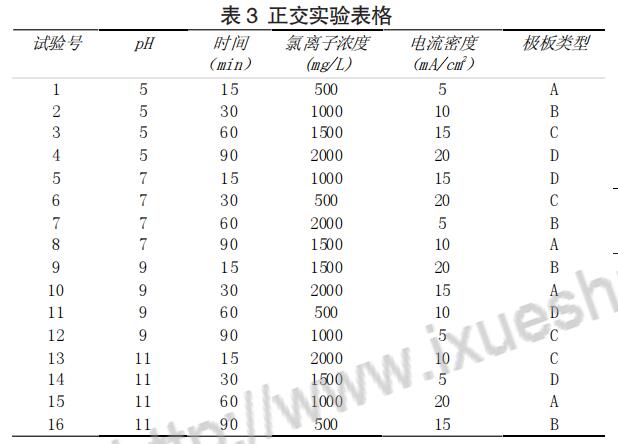
根据正交实验表 3 进行各组实验。
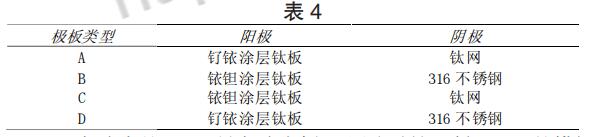
极板类型对应的极板材料见表 4。
2.4 实验步骤
以 1 号实验为例。a.用硫酸铵配制 8mg/L 的模拟氨氮污水,倒入电解槽中)。b.添加 0.825g 氯化钠(500mg/L Cl-),调节pH=5。c.安装电极板至电解槽两侧,连接电线至直流稳压电源。d.设置稳压直流电源的电流为 0.5A,打开电源并记录开始时间点解时 间为 15min。e.电解结束后,测试水样的 pH,并取样测试氨氮含量,记录结果。f.调整参数,重复 a-e,进行下一组实验。
3 实验结果与讨论
3.1 试探性实验结果及分析
氯离子浓度和氨氮去除的关系。在 做正交实验之前,对氯离子的添加量做了一组试探性实验。实验结 果如见表 5。初始氨氮浓度 8.96 mg/L,电流密度 5mA/cm2,极板间距10cm,电解时间 30min,pH=5.68。
实验表明,氯离子含量对氨氮的去除具有重要的意义。氯离子 浓度<400mg/L 时,氨氮含量不降反增,其原因初步分析如下: 氯离子含量过低,电解液中主要反应为式(15),次要反应为 (16)和(17)。
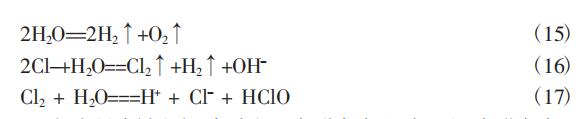
此时,大量水被电解,仅有极少部分氯气生成,用以氧化氨氮。 也就是说,电解水的量大于氨氮的处理量,造成了氨氮被“浓缩”,含 量不降反增。当氯离子浓度达到一定值以后,主要反应为(16)和 (17),此时有足够的氯气溶解于水氧化氨氮。从这点来说,氯离子浓 度越高,处理效果越好。但氯离子浓度过高,则会导致电流效率低 下、能源浪费的问题,甚至会有氯气逸出,造成安全隐患。因此,应当 合理控制氯离子浓度,原则是在保障氨氮去除效果的同时,尽量降低氯离子浓度。
3.2 正交试验结果及分析
正交试验的结果采用方差分析法,分 析结果见表 6。从正交实验的极差分析中我们可以确定各因子对氨氮去除效果的主次顺序为:时间、氯离子浓度、pH、电流密度、极板 类型。最优水平组合为 pH=7,电解时间为 90min,氯离子浓度为2000mg/L,电流密度为 20mA/cm2,电极板组合为铱钽钛板-316 不锈钢。同时根据分析结果可以得出,电解时间越长、氯离子浓度越 高、电流密度越大,处理的效果越好。但是也应该注意,电解时间过 长和电流密度过高,会造成电流效率低下、能耗高的问题;氯离子 浓度过高有可能会使过量的氯气逸出,造成安全隐患。
注:《水质氨氮的测定纳氏试剂分光光度法(HJ 535—2009)》中氨氮检测下限为0.1mg/L,此处浓度为低于检测下限。
4 结论
根据正交实验的结果,可以确定在一定的工艺条件下,能够将出水氨氮含量减少至 0.2mg/L 及其以下。阳极材料需要选用贵重金 属涂层钛电极,阴极可以选用防腐蚀性能较好的 316 不锈钢板。
-
崔屹:电化学法修复重金属污染的土壤2019-09-10
-
技术交流:美国地下水污染及修复治理技术 电化学砷修复技术2019-09-03
-
电化学技术应用循环水处理分析及调研2017-08-11
-
金川热电化学水处理系统扩能改造项目招标2017-06-03


